在当今的医学领域,乳腺癌作为一种严重威胁女性健康的疾病,其治疗一直是科研工作者们关注的焦点。
乳腺癌的发展与雌激素受体密切相关,其中 ERα 被视为治疗乳腺癌的重要靶标。
能够拮抗 ERα 活性的化合物有望成为治疗乳腺癌的候选药物。然而,药物筛选是一个复杂而艰巨的过程。
一方面,在传统的药物筛选中,面临着诸多难点。各类化合物具有繁多的特征属性,如 ADMET 特性和化合物生物活性等。
如何从众多特征中挑选出影响化合物活性的关键特征,以及确定这些关键特征的取值范围以保证药物具有较高的生物活性,同时在 ADMET 五个特性中至少有三个表现良好的情况下使化合物活性最大化,这些都是极具挑战性的问题。
另一方面,随着科技的不断进步,人工智能和机器学习技术为药物研发带来了新的机遇。主成分分析、机器学习和多目标优化等方法在药物筛选中展现出了巨大的潜力。通过这些方法,可以有效地处理复杂的药物数据,挖掘出关键特征,预测药物的生物活性和参数范围,实现多目标的优化。
与此同时,量子计算的发展也为药物发现提供了新的思路。量子生成对抗网络(Quantum GAN)结合了量子计算和生成对抗网络的优势,能够处理高维数据,为药物研发提供了新的途径。通过量子电路和经典神经网络的结合,有望生成具有特定药物特性的分子,为新药研发带来新的突破。
本文将围绕主成分分析、机器学习和多目标优化在化合物特征药物筛选中的应用,以及量子生成对抗网络在药物发现(附数据代码)中的研究展开,旨在探索更加高效、准确的药物筛选和发现方法,为乳腺癌的治疗提供新的候选药物。
主成分分析、机器学习、多目标优化对化合物特征进行药物筛选
乳腺癌的发展与雌激素受体密切相关。目前抗激素治疗常用于ERα表达的乳腺癌患者。因此ERα被认为是治疗乳腺癌的重要靶标,能够拮抗ERα活性的化合物可能是治疗乳腺癌的候选药物。
在该项目中出现了各种难点,例如,各类化合物的特征属性繁多,比如有ADMET(Absorption,Distribution,Metabolism,Excretion,Toxicity)特性和化合物生物活性等。该如何选择关键特征是大问题。
选择了关键特征,如何确定该特征的取值大小才能保证该药品具有生物活性,首先要保证药物有效,才能讨论药性。
针对五个关键的特性ADMET如何在尽量让五个特性表现良好的情况下,让化合物活性尽量的高,这样的化合物的分子描述符的取值范围的寻找较为困难。
Chenhao Wu
可下载资源
9.Python用RNN循环神经网络:LSTM长期记忆、GRU门循环单元、回归和ARIMA对COVID-19新冠疫情新增人数时间序列预测
解决方案
任务/目标
- 在众多特征中找到影响化合物活性的关键特征。
- 找到关键特征的取值范围使得药物的生物活性较高。
- 找到在使得药效达标(ADMET五个特性至少有三个表现良好)的情况下生物活性较高
数据源准备
该项目的数据源由其他企业提供
数据清洗
视频
LSTM神经网络架构和原理及其在Python中的预测应用
视频
【视频讲解】神经网络、Lasso回归、线性回归、随机森林、ARIMA股票价格时间序列预测
视频
Python、R时间卷积神经网络TCN与CNN、RNN预测时间序列实例
视频
卷积神经网络CNN肿瘤图像识别
视频
CNN(卷积神经网络)模型以及R语言实现
视频
【视频讲解】Python深度学习股价预测、量化交易策略:LSTM、GRU深度门控循环神经网络附代码数据
视频
ResNet深度学习神经网络原理及其在图像分类中的应用Python代码
在数据中将大量字段为空的药物删除,少量字段为空的补0。针对第一个问题给他贴好标签,将化合物活性贴好标签,分为1-10,10个等级,在5以上的为活性较高,5以下的活性较低,更进一步,在5以上就贴上1,在5以下就贴上0。便于后续对其进行主成分分析。
针对第二个难题,是一个定量预测问题。我们将数据中需要的药物提取出来。
第三个问题是一个多目标优化的问题。我们同样给药物贴好标签,在ADMET属性中,满足3个或以上的我们给他贴1标签,否则贴0标签,后续对其进行多目标优化。
构造模型
针对问题1.我们使用了不同的主成分分析,包括相关性分析,随机森林 特征选择,基于相关性的特征子集选择算法,基于分类器的属性价值评估算法,Relief 算 法,基于分类器的特征子集选择算法,信息增益排序等。发现RReliefF算法更优秀,这里我们选择了RReliefF方法。
第二个问题采用了多种机器学习方法。包括极限随机树(ET),多层感知机(MLP),支持向量机回归(SVR),并对其进行模型评价,发现ET效果最好,并可以预测所有参数的范围。
第三个问题是多目标优化的问题,针对这类问题,我们使用的是粒子群算法,通过调节超参,达到近似全局最优解。
划分训练集和测试集
所有的药物是独立的样本,所以我们直接采用十折交叉验证即可。
上线之后的迭代,在得到所有化合物参数性能指标之后,我们要交给专业人士去临床验证这些药物。
部分模型预测结果:





该项目涉及到分类模型,回归模型,优化问题。是个综合的项目,都达到了不错的性能。
Python量子生成对抗网络QGAN神经网络的药物发现研究|附数据代码
开发新药是一项极具挑战性的工作,传统方法耗时漫长且成功率较低。随着人工智能和机器学习的发展,为新药研发带来了新的机遇。本文介绍了一种基于量子生成对抗网络(Quantum GAN,QGAN)的方法在药物发现中的应用,通过利用量子计算的优势处理高维数据,为药物研发提供了新的思路和方法。
一、引言
新药开发是一个复杂而漫长的过程,从靶点发现到临床试验,往往需要数年甚至数十年的时间。而且,经过重重筛选和测试,最终能够成功上市的药物寥寥无几。近年来,人工智能和机器学习技术在各个领域取得了显著的进展,也为药物研发带来了新的希望。其中,生成对抗网络(GAN)在图像生成等领域表现出色,而将量子计算与 GAN 相结合,有望在药物发现中发挥更大的作用。
二、量子相关术语
(一)量子电路
量子电路是由一系列门组成的有序集合,用于改变量子比特的状态以执行特定的量子运算。
(二)量子噪声
量子噪声是指任何可能导致量子计算机出现故障的因素。当量子比特暴露于噪声源时,量子计算机中的信息会受到干扰和降级。
(三)量子 GAN
在量子 GAN 中,GAN 模型的生成器和判别器在量子计算机或设备上进行训练,这些设备能够轻松处理高维数据(即量子数据)。
(四)带混合发生器的 Quantum GAN
QGAN-HG 由参数化量子电路组成,可提供量子比特大小维度的特征向量。需要一个经典的神经网络来生成所需的原子向量和键矩阵,以构建分子的图形表示,其中节点表示原子,边表示键。
三、QGAN量子电路
该电路在量子层的帮助下提供特征向量,其计算时间为 O(poly(log(M)))。量子层由初始化、参数化和测量三个阶段组成。在初始化部分,从 [-π, π] 中均匀采样两个参数 z1 和 z2,然后将其转换为数学形式,并对所有层重复操作,以生成酉矩阵 U(θ)。最后,通过对最终量子态应用量子运算来获取特征向量。图中提到的 Ry 和 Rz 是旋转门。
随时关注您喜欢的主题

四、QGAN-神经网络
从 QGAN电路生成特征向量后,这些向量被输入到经典神经网络中。此神经网络的输出包含原子层和键层,用于生成原子向量和键矩阵。
五、用于计算的指标
(一)Frechet 距离
它用于测量真实分子和合成分子分布之间的相似性。
(二)药物特性
药物性质包括药物可能性、溶解度、合成性等。这些特性与其他属性一起使用 RDKit 进行测量。
六、模型架构
如图所示:

- 第一张图片由药物片段和结合位点(受体)组成。药物的形状若适合受体,则有可能治愈疾病,这可以用锁和钥匙的概念来解释,受体如同锁,药物如同钥匙。
- 第二张图像由量子阶段和经典阶段组成,以虚线分隔。
- 第三张图片由原子和键矩阵组成,用于构建合成分子的图形结构。
- 在最后一步中,将真实分子和合成分子输入经典判别器以区分两者,并使用 RDKit 包评估 Frechet 距离和药物特性。最终预测将反馈到两个神经网络和量子电路,以便在每个训练周期更新所有参数。
七、用于训练模型的数据集
本研究使用的数据集由 134K 个稳定的有机小分子和多达 9 个重原子组成。
八、依赖
此模型依赖于以下框架:
- python>=3.5
- pytorch>=0.4.1
九、模型实现
(一)导入所需库和包
首先,导入所有必需的库和包,为后续的模型构建和训练做准备。
(二)设置量子比特单元并生成量子电路
初始化两个随机均匀噪声参数 z1 和 z2,然后为原子向量和节点矩阵生成一个电路。
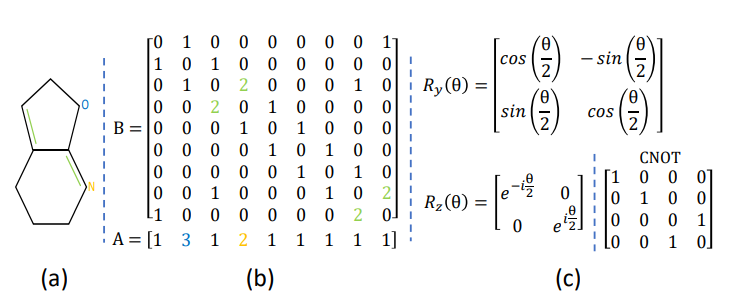
以下是生成量子电路的代码及解释
# 这里 a 是邻接矩阵,x 是节点
mols, _, _, a, x, _, _, _, _ = self.data.next_train_batch(self.batch_size)
a = torch.from_numpy(a).to(self.device).long() # 邻接矩阵。
x = torch.from_numpy(x).to(self.device).long() # 节点。
# "将标签索引转换为独热向量
a_tensor = self.label2onehot(a, self.b_dim)
x_tensor = self.label2onehot(x, self.m_dim)
z = torch.stack(tuple(ibm_sample_list)).to(self.device).float()
# Z-to-target
# 计算假图像的损失。
edges_logits, nodes_logits = self.G(z)
# 用 Gumbel softmax 进行后处理
(edges_hat, nodes_hat) = self.postprocess((edges_logits, nodes_logits), self.post_method)
logits_fake, features_fake = self.D(edges_hat, None, nodes_hat)
g_loss_fake = - torch.mean(logits_fake)
# 计算真图像的损失
# 真实奖励
rewardR = torch.from_numpy(self.reward(mols)).to(self.device)
# 假图像奖励
(edges_hard, nodes_hard) = self.postprocess((edges_logits, nodes_logits), 'hard_gumbel')
edges_hard, nodes_hard = torch.max(edges_hard, -1)[1], torch.max(nodes_hard, -1)[1]
mols = [self.data.matrices2mol(n_.data.cpu().numpy(), e_.data.cpu().numpy(), strict=True)
for e_, n_ in zip(edges_hard, nodes_hard)]
rewardF = torch.from_numpy(self.reward(mols)).to(self.device)
# 价值损失
value_logit_real,_ = self.V(a_tensor, None, x_tensor, torch.sigmoid)
value_logit_fake,_ = self.V(edges_hat, None, nodes_hat, torch.sigmoid)
g_loss_value = torch.mean((value_logit_real - rewardR) ** 2 + (
value_logit_fake - rewardF) ** 2)这段代码主要进行模型的推理和损失计算。首先从数据集中获取训练批次的数据,然后对生成器和判别器的输出进行处理,计算真假图像的损失和价值损失,并通过 Frechet 距离计算键和原子的距离损失,最后将这些损失存储在一个字典中。
(五)分子评估
最后一步是通过 RDKit 评估所有分子,并输出评估结果。

结论
本文介绍了一种基于量子生成对抗网络的药物发现方法,通过量子电路和经典神经网络的结合,能够生成具有特定药物特性的分子。该方法在数据集上进行了训练和测试,取得了较好的结果。然而,该方法仍处于研究阶段,需要进一步的改进和优化。未来,可以通过增加数据集的规模、改进模型架构和优化算法等方式,提高模型的性能和泛化能力,为药物发现提供更有力的支持。

关于分析师
Chenhao Wu
在此对 Chenhao Wu 对本文所作的贡献表示诚挚感谢,他在上海海事大学完成了计算机应用技术专业的硕士学位,专注机器学习、数据处理领域。擅长 WEKA、Python、Java。

 Python农作物种植策略研究GA-BP神经网络、蒙特卡洛算法、自注意力Stacking集成模型及粒子群算法PSO优化基于华北山区乡村农作物数据及地块数据
Python农作物种植策略研究GA-BP神经网络、蒙特卡洛算法、自注意力Stacking集成模型及粒子群算法PSO优化基于华北山区乡村农作物数据及地块数据 MATLAB奥运会奖牌预测研究 —CNN神经网络、逻辑回归、Liang-Kleeman信息流、多元回归及随机森林模型的因果关联与概率预测|附代码数据
MATLAB奥运会奖牌预测研究 —CNN神经网络、逻辑回归、Liang-Kleeman信息流、多元回归及随机森林模型的因果关联与概率预测|附代码数据 Python实现Transformer神经网络时间序列模型可视化分析商超蔬菜销售数据筛选高销量单品预测|附代码数据
Python实现Transformer神经网络时间序列模型可视化分析商超蔬菜销售数据筛选高销量单品预测|附代码数据 Python银行客户数据流失预测SMOTE平衡数据实现神经网络、SVM、决策树、随机森林与超参数调优|附代码数据
Python银行客户数据流失预测SMOTE平衡数据实现神经网络、SVM、决策树、随机森林与超参数调优|附代码数据



